Molecular Identification of Phytoplasmas Associated with Witches' Broom in Rose and Spiraea
Molecular Identification of Phytoplasmas Associated with Witches' Broom in Rose and Spiraea
植原体(Phytoplasma),原称 Mycoplasma-like Organism(MLO),是一类无细胞壁、不能人工培养、存在于植物筛管内的专性寄生菌。植原体主要依靠叶蝉等从韧皮部取食的半翅目昆虫传播,也可由菟丝子和嫁接等传播,能够引起植物丛枝、黄化、簇生、矮化、顶枯等症状
传统上,主要是根据寄主的种类及其症状等生物学性状和介体昆虫的特性对植原体进行鉴定和命名。但该方法非常复杂和费力,难以鉴定多种植原体复合侵染引起的病害,经常导致片面甚至错误的结论
本研究利用巢式PCR对表现丛枝症状的绣线菊和玫瑰进行植原体分子检测,并将克隆到的16S rRNA基因、延伸因子
1 材料与方法
1.1 材料
表现丛枝、黄化、小叶和顶枯症状的绣线菊样品采自山东省青州市;表现叶片畸形、丛枝、顶枯症状的玫瑰样品采自山东省平阴县玫瑰研究所;克隆载体pMD18-T、PCR产物回收试剂盒、限制性内切酶及其他酶类等分子生物学试剂产品均购自TaKaRa公司。
1.2 嫁接试验及电镜观察
以有病害症状的玫瑰为接穗,通过芽接的方法嫁接到5株无症状的玫瑰上。嫁接后放置于无虫温室中,5~7周后观察症状。
取表现典型症状的玫瑰韧皮部组织(2mm×2mm),放入3%戊二醛、1%四氧化锇中双重固定,乙醇(10%~70%)、丙酮(0~100%)系列脱水,Epon 812包埋,超薄切片后醋酸铀和柠檬酸铝双染色,在JEM-1200 X型透射电镜下观察。
1.3 总DNA的提取
提取方法按参照文献[8]的方法进行,总DNA于-20℃保存备用。
1.4 16S rRNA、tuf基因及rp基因PCR扩增
参照文献
以提取的玫瑰丛枝植原体的总DNA为模板,参照Schneider等
引物名称Primername引物序列Primersequence退火温度TmR16mF25′-CATGCAAGTCGAACGGA-3′60R16mR15′-CTTAACCCCAATCATCGAC-3′60R16F25′-ACGACTGCTAAGACTGG-3′55R16R15′-TGACGGGCGGTGTGTACAAACCCCG-3′55fTufu5′-CCTGAAGAAAGAGAACGTGG-3′50rTufu5′-CGGAAATAGAATTGAGGACG-3′50rpF15′-GGACATAAGTTAGGTGAATTT-3′55rpR15′-ACGATATTTAGTTCTTTTTGG-3′55
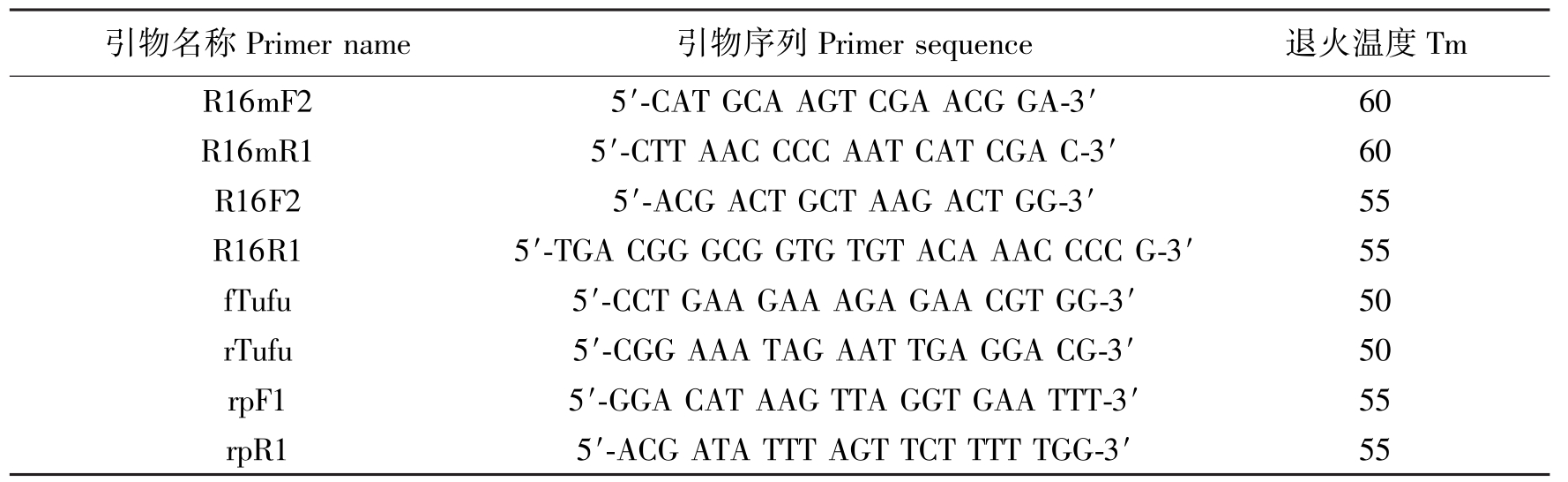
Table 1 Primers used in this research to amplify 16S rRNA gene tuf gene and rp gene
1.5 PCR产物的克隆与序列分析
PCR产物回收后与pMD18-T连接,连接产物转化大肠杆菌DH5α感受态细胞,挑取筛选平板上的白色菌落培养,提取质粒,经PCR和酶切鉴定为阳性的重组质粒送上海英骏生物技术有限公司测序。将所得DNA 序列输入GenBank进行Blast检索,采用DNASTAR和MEGA3.1软件对所得到的核苷酸序列与GenBank中收录的相应基因的核苷酸序列进行比较和分析,并构建系统进化树。
2 结果与分析
2.1 绣线菊、玫瑰丛枝病病株症状
感病绣线菊植株表现为节间短缩,部分枝条丛生,叶片黄化、变小畸形、顶部嫩梢枯死,植株矮化。感病玫瑰植株表现典型丛枝症状,叶片变小畸形、顶部嫩梢枯死(图1)

Figure 1 Symptoms of spiraea witches' broom and rose witches' broom
2.2 嫁接试验及电镜观察结果
将健康玫瑰嫁接到表现病害症状的玫瑰上,5~7周后,接穗新长出的嫩枝表现黄化、丛枝、畸形等症状。
对玫瑰丛枝植原体进行电镜超微结构观察,在嫩茎韧皮部筛管中观察到典型的植原体。其主要形态为圆形和椭圆形,有明显的单位膜结构,直径为300~600nm,胞内可见核糖体蛋白体颗粒和DNA细链。
2.3 PCR扩增结果
以表现丛枝、叶片黄化等症状的绣线菊总DNA为模板,用巢式PCR扩增其16S rRNA基因,得到长度约为1.2kb的片段。以玫瑰丛枝植原体的总DNA为模板,用PCR扩增16S rRNA基因、
2.4 16S rRNA基因序列分析
通过测定2个PCR克隆到的片段的序列,确定了SWB的16S rRNA基因含有1236个核苷酸,G+C的含量为47.09%;RWB的16S rRNA基因含有1432个核苷酸。GenBank登录号分别为EF176608、EF199938。
将两分离物与GenBank中17个植原体分离物的核苷酸序列进行比对和系统进化分析。从系统进化树中可以看出,两个分离物全部聚类到16SrⅠ组中,与16SrⅠ-B亚组的西方翠菊黄化植原体、马里兰翠菊黄化植原体及16SrⅠ-D亚组的泡桐丛枝植原体聚集为一簇。两个分离物与植原体16SrⅠ组中各亚组的分离物核苷酸同源性均达到99%以上,其中SWB与16SrⅠ-B亚组中的西方翠菊黄化植原体(SAY)同源性高达99.6%,与本研究的另外两个分离物RWB、PaWB的同源性为99.7%和99.8%。而RWB分离物与PaWB的同源性最高为99.9%,与植原体僵顶病组(Stolbur group)(16Sr Ⅻ)的草莓花瓣变绿症(Strawberry virescence,AY377868)植原体核苷酸的同源性为95.8%,与其他各组的核苷酸同源性为89.5%~92.8%。说明SWB、RWB分离物属于西方翠菊黄化植原体(图2)。
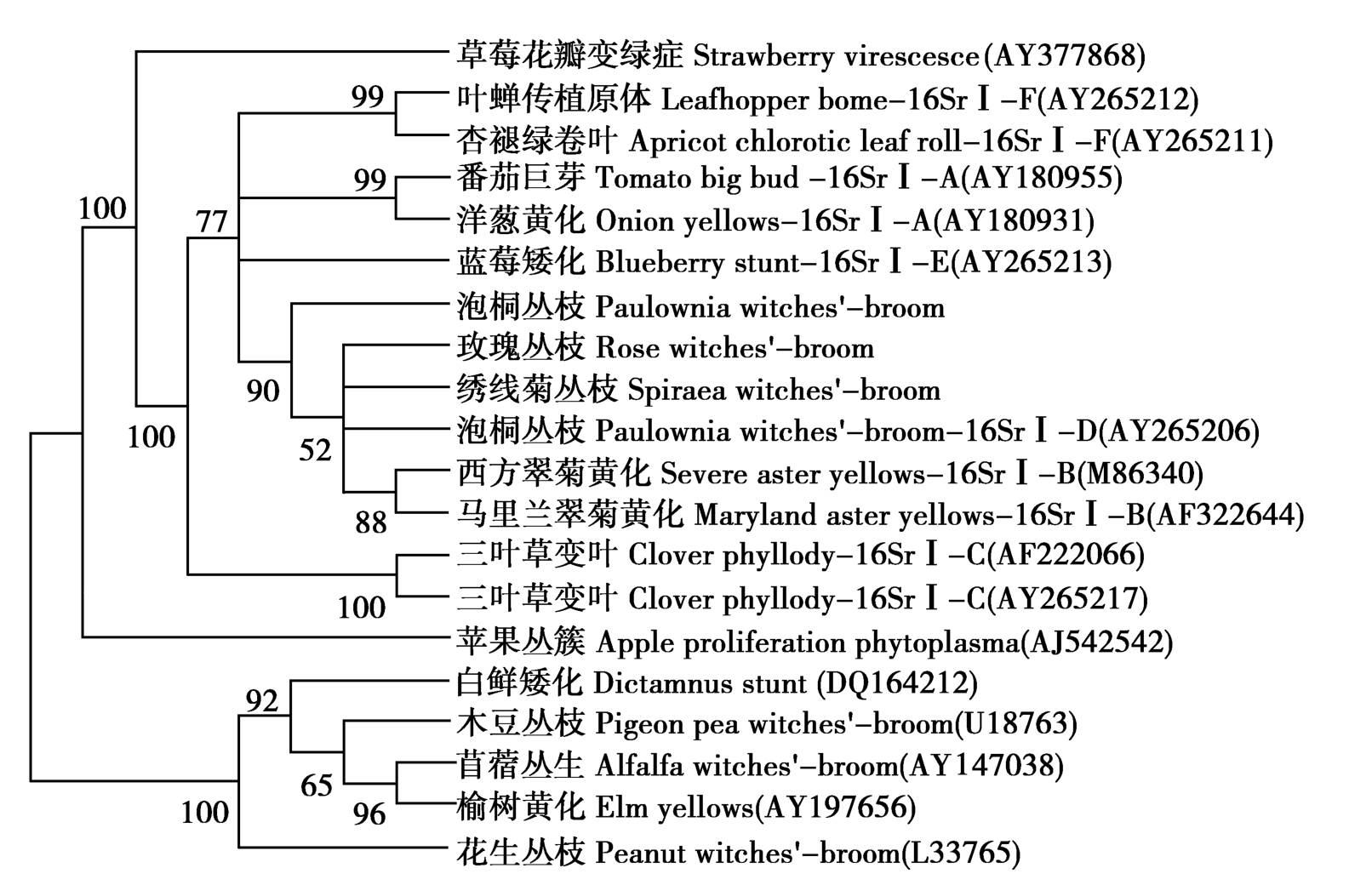
Figure 2 Phylogenetic tree based on 16S rRNA nucleotide sequence with maximum-likelihood method in MEGA3.1 software package
2.5 玫瑰丛枝植原体tuf基因及rp基因
经序列测定,确定玫瑰丛枝植原体的延伸因子(EF-Tu)
将玫瑰丛枝植原体分离物与GenBank中21个植原体分离物的
3 结论与讨论
本研究利用巢式PCR从表现丛枝症状的绣线菊中扩增到了1236bp的片段。序列测定和比较的结果表明,与这两种病害相关的植原体均为西方翠菊黄化植原体。
前人对植原体侵染绣线菊研究较少,国外仅报道由植原体‘
我们采集了表现丛枝、顶枯症状的玫瑰和表现丛枝症状的泡桐,经PCR检测表明其病原为植原体。序列分析表明,两分离物的16S rRNA基因、延伸因子(EF-Tu)
在根据16S rRNA基因进行序列比对及构建系统进化树时发现,两个分离物与16SrⅠ-B亚组的西方翠菊黄化植原体、马里兰翠菊黄化植原体及16SrⅠ-D亚组的泡桐丛枝植原体在构建的系统进化树中聚集成一簇。Lee等









