Cloning and Analysis of 3′-terminal Genomic Sequence of a Beet Mosaic Virus Isolate from Lettuce*
甜菜花叶病毒(Beet mosaic virus,BtMV)属于马铃薯Y病毒属(Potyvirus)。它是一个世界性的病原,主要由蚜虫以非持久方式传播,并可以通过机械接种和嫁接方式传播,但不能通过种子以及花粉传播。20世纪50年代末德国首次报道了BtMV在甜菜上的发生[1]。1981年Liu等报道了BtMV在北京地区菠菜上的发生,是我国对BtMV的首次报道[2]。BtMV寄主主要是藜科植物,可系统侵染甜菜(Beta vulgaris),局部侵染菠菜(Spinacia oleracea)、苋色藜(Chenopodium amaranticolor)、昆诺藜(C.quinoa)等。目前仅有美国华盛顿分离物、德国分离物、中国新疆以及内蒙古分离物的全序列以及英国和斯洛伐克少数几个分离物3′端部分序列被报道,这些分离物均来源于甜菜[3,4]。
莴苣(Lactuca sativa)属于菊科莴苣属,一年或两年生草本植物。莴苣是我国常见蔬菜之一,在我国大部分地区均有种植。2007年,我们在泰安郊区蔬菜种植区调查病毒病时,发现莴苣上发生病毒病较为严重。感病植株叶片呈黄绿相间的花叶症状,植株严重矮缩。初步的血清学试验表明,该分离物是马铃薯Y病毒属病毒。用针对该属病毒的兼并引物进行RT-PCR扩增,获得此病毒基因组3′端片段,经序列分析表明为BtMV。
1 材料与方法
1.1 材料
1.1.1 供试毒源 莴苣病叶样品采自山东泰安郊区菜田,经枯斑寄主昆诺藜(C.quinoa)单斑分离3次后繁殖保存于本生烟(Nicotiana benthamiana)上,并取发病叶用硅胶保存。
1.1.2 载体、试剂与菌株 大肠杆菌DH5α由本实验室提供;Trizol购自invitrogen公司;PCR产物回收试剂盒购自博大泰克公司;M-MLV反转录酶、RNase抑制剂(HPRΙ)购自Promega公司;无RNase的水,克隆载体pMD18-T、Taq DNA 聚合酶购自TaKaRa公司;硝酸纤维素膜购自Pall Gelman公司产品;碱性磷酸酯酶标记的A蛋白购自Sigma公司;其他化学试剂均为国产分析纯;BtMV的血清由中国农业大学韩成贵教授提供,其余抗血清由本实验室制备。
1.2 方法
1.2.1 SDS-琼脂免疫双扩散试验 以常规琼脂双扩散法进行,1g病叶样品加1ml PB缓冲液再加1ml 3%SDS研磨,将汁液6000r/min离心5min。取上清液适量加到琼脂糖凝胶中,与黄瓜花叶病毒(Cucumber mosaic virus,CMV)、烟草花叶病毒(Tobacco mosaic virus,TMV)、芜菁花叶病毒(Turnip mosaic virus,TuMV)、马铃薯X病毒(Potato virus X,PVX)、马铃薯Y病毒(Potato virus Y,PVY)的抗血清反应,加样后在37 ℃下放置,12h后观察结果。
1.2.2 RNA提取 采用 Trizol法(Invitrogen)提取总RNA。取0.2g具典型症状病叶于干热灭菌的研钵中,液氮研磨至粉末,迅速转移至1.5ml离心管中,加1ml Trizol剧烈振荡,静置10min;加200μl氯仿后充分振荡15s,静置5min,于4℃、12000r/min离心15min;将上清转移至另一1.5ml离心管中,加入等体积冰冷的异丙醇混匀,室温放置10min,4℃、12000r/min离心10min,沉淀用DEPC处理灭菌水配制的75%乙醇洗涤;室温干燥,加入适量无RNase的水溶解RNA,-80℃保存备用。
1.2.3 RT-PCR扩增 以提取的总RNA为模板,在Oligo d(T)引物引导下利用M-MLV反转录酶合成第一链cDNA。用针对马铃薯Y病毒属病毒3′端序列设计的简并引物Sprimer和K11465(表1),扩增病毒RNA基因组的3′端序列。扩增条件如下:94℃预变性3min;94℃变性30s,60℃退火30s,72℃延伸2min,30个循环;72℃延伸10min。扩增产物经1%琼脂糖凝胶电泳检测。
1.2.4 PCR产物的克隆与测序 PCR产物回收后与pMD18-T连接,连接产物转化大肠杆菌DH5α感受态细胞,提取质粒,经PCR扩增和酶切鉴定为阳性的重组质粒送北京英俊有限公司测序。
NamePrimersequenceTmReferencesOligod(T)5′-GGTCGACTGCAGGATCCAAGC(T)15-3′[5]K114655′-GGTCGACTGCAGGATCCAAGC-3′68[5]Sprimer?5′-ATAGGATCCCTGCAGGGBAAYAAYAGYGGDCARCC-3′69~78[6]
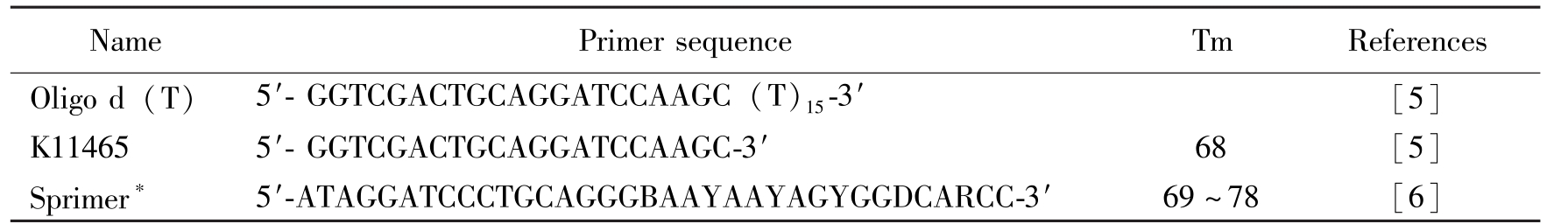
Table 1 Primers used for cDNA synthesis, PCR amplification and DNA sequencing
1.2.5 Western blotting分析 参考文献中[7,8]的方法,用Western blotting验证采集的莴苣样品、单斑分离后保存在本生烟上的样品与BtMV血清的关系。第一抗体为原核表达制备的抗血清,第二抗体为碱性磷酸酯酶标记的A蛋白,用BCIP/NBT显色。
1.2.6 DNA序列比较与分析 将所得DNA序列输入GenBank进行BLAST检索,采用DNAStar和MEGA3.1软件对所得到的核苷酸序列与GenBank中收录的BtMV分离物的相应序列进行比较和分析,构建系统进化树。
2 结果与分析
2.1 病株田间症状表现
感病莴苣植株表现明显的矮缩症状,叶片呈黄绿相间的花叶症状,叶片变小并伴有明显的皱缩(图1)。

Figure 1 Symptoms of lettuce infected by BtMV-SD
2.2 血清学鉴定
SDS-琼脂扩散试验结果显示样品与TuMV抗血清和PVY抗血清均有沉淀反应,说明样品中含有马铃薯Y病毒属的病毒。
2.3 基因的扩增及克隆
以提取的病叶样品总RNA为模板,经RT-PCR扩增,得到长度约为1.7kb的目的片段(图2),与预期的大小相一致。扩增产物经纯化后克隆到pMD18-T载体上。经蓝白斑筛选和酶切鉴定,得到含有目的片段的重组子。

Figure 2 RT-PCR amplification of 3′-cDNA of BtMV-SD
2.4 序列测定与分析
通过测定2个PCR反应克隆到的片段序列,确定了插入片段的核苷酸序列长度1629bp。序列已登录GenBank,登录号为EF633501。扩增产物包含630bp NIb编码序列、831bp CP编码序列及168bp非编码区序列(3′-UTR)。在由此推导其氨基酸序列中,NIb与CP的切割位点为VTYQ/G,符合多数马铃薯Y病毒属病毒NIb与CP切割位点的保守基序为VXXQ的特征[9]。NIb氨基酸序列中存在依赖RNA的RNA聚合酶(RNA-dependent RNA polymerase,RdRp)保守氨基酸序列GDD。CP序列中含有蚜虫传播马铃薯Y病毒属病毒所必需的DAG基序。
分离物BtMV-SD 3′ 端序列与GenBank中已登录的斯洛伐克(BtMV-SL,AF363639)、美国华盛顿(BtMV-Wa,AF206394)、中国内蒙古(BtMV-IM,DQ674263)、中国新疆(BtMV-XJ,DQ674264)、英国(BtMV-UK,AF203540)、中国新疆2(BtMV-XJ2,DQ345522)以及未登录的德国(BtMV-G)[10] 6个BtMV分离物的核苷酸序列同源性分别为98.8%、91.1%、98.6%、97.7%、98.5%、97.5%、98.8%,氨基酸序列同源性分别为99.2%、94.3%、99.5%、98.4%、99.4%、98.9%、99.5%。除了BtMV之外,马铃薯Y病毒属中的落葵皱缩花叶病毒(Basella rugose mosaic virus,BaRMV)(DQ394891)与BtMV-SD的核苷酸同源性最高,为63.5%。
据CP编码序列构建的系统进化树表明,8个分离物可以分为两组:欧亚大陆组(Euroasia group)与美洲组(America group),结果与Xiang等[4]的相一致。其中美国华盛顿分离物BtMV-Wa位于美洲组,包括BtMV-SD在内的其他分离物位于欧亚大陆组(图3)。BtMV-SD与BtMV-SL位于同一分支,两者在进化关系上最为接近。
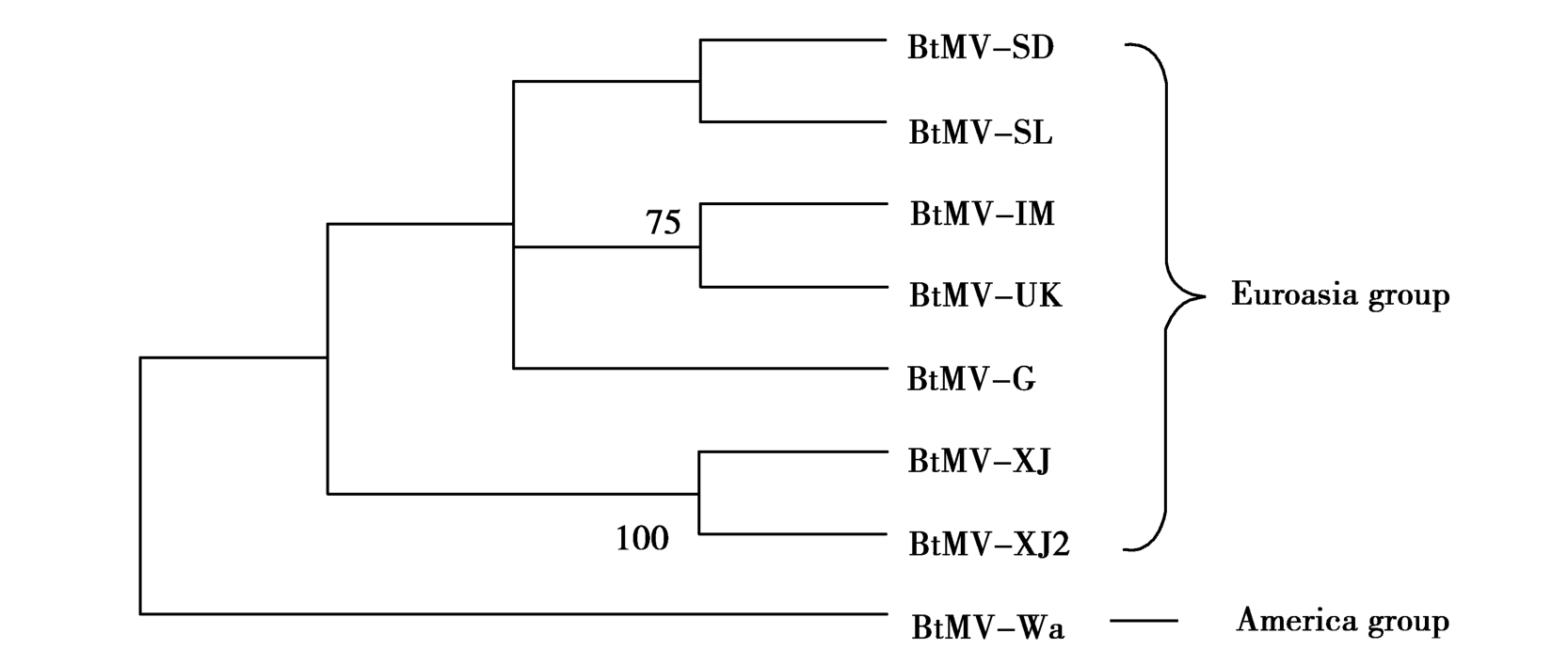
Figure 3 Phylogenetic tree based on CP-coding sequence of 8 BtMV isolates
2.5 Western blotting分析
Western blotting分析表明,自然发病的莴苣样品以及接种发病的本生烟样品均与BtMV血清有较强的特异性反应,而本生烟健康植株则无反应。

Figure 4 Western blotting analysis of BtMV-SD
3 讨论
在用有些病毒的多克隆抗体检测样品时,经常会出现交叉反应,这在马铃薯Y病毒属病毒中也非常普遍[11]。本研究的样品在SDS-琼脂免疫双扩散试验中与TuMV和PVY的抗血清均有沉淀反应,表明该分离物可能有马铃薯Y病毒属的病毒。通过比较病毒基因组3′端约1.7kb的序列,证明该病毒分离物为BtMV。Western blotting进一步证实了该结果。
病毒病是莴苣生产中的主要病害之一。病毒的复合侵染在田间也非常普遍。已报道侵染莴苣的病毒有莴苣花叶病毒(Lettuce mosaic virus,LMV)、蒲公英黄花叶病毒(Dandelion yellow mosaic virus,DYMV)和CMV。先前报道BtMV寄主主要是甜菜、菠菜等藜科植物,而不易侵染莴苣。本文首次报道BtMV在自然条件下能够侵染莴苣并造成危害。














