Primary Study of Oligochitosan Inducing Resistance to Sclerotinia sclerotiorum on Brassica napus
Primary Study of Oligochitosan Inducing Resistance to Sclerotinia sclerotiorum on Brassica napus
菌核病为我国油菜三大病害之首,严重影响油菜的产量和品质,目前通过使用化学农药等措施对其进行防治,但是效果不很明显,且长期使用化学农药会造成对环境的严重污染。所以利用植物自身诱导抗病性对菌核病进行防治是现在农业生产中的新趋势。植物诱导抗病性是植物抵御病害侵袭的重要机制之一,具有作用效果明显,广谱性及环境友好等优点,作为一种经济有效的抗病策略,在农业可持续病害防治中具有广阔的应用前景,日益受到人们的关注。我们实验室开发研制的生物农药中科六号(壳寡糖)在田间及温室实验中被证实可诱导烟草等作物对相应的病害产生防治作用
1 材料和方法
1.1 材料
1.2 温室试验? 基金项目:国家高科技研究发展专项经费(2006AA10A213;2007AA091600);中国科学院知识创新工程重要方向项目(KSCX2-YW-N-007)。
1.3 脂氧合酶测定
1.4 抑菌试验
用滤纸片法在PDA培养基平板上进行抑菌试验,在培养基平板正中央接0.15cm大小的核盘菌菌丝琼脂块,打孔器取直径5~6mm的滤纸片,在无菌条件下浸泡壳寡糖溶液均匀后放置平板上,每皿放置5点,其中一点为对照即浸无菌水,另设不放滤纸片的培养皿平板为阴性对照,观察不同浓度处理滤纸片后其周围病菌生长状况,与对照相比,经72h恒温培养后,根据抑菌圈大小判断抑菌效果。壳寡糖溶液浓度50mg/kg,200mg/kg,500mg/kg,1000mg/kg。
2 结果与分析
2.1 温室试验结果
依据田间试验诱抗效果取最佳浓度50μg/ml进行温室试验,试图寻找防效最好的预处理时间点。对照植株在12h时就发病明显,96h后叶片枯萎。而经壳寡糖预处理者接核盘菌后12h内症状不明显,24h时产生病症,120h后叶片出现枯萎现象(图1),说明壳寡糖处理能延缓菌核病发病,壳寡糖预处理的植株都表现出一定的抗菌核病的能力接菌(表1),提前三天(72h)预处理有最佳效果,在120h时防效为54.60%,试验结果显示防效可达120h以上。

图1 壳寡糖提前三天预处理后油菜接菌核病后表型变化(0h,12h,24h,48h,120h)
Figure 1 Appearance of 72h before COS pretreated B.napus leaves challenged with S.sclerotiorum.(0h,12h,24h,48h,120h)
预处理时间病情指数(%)防效(%)022.91—提前24h15.6231.8提前48h14.5836.35提前72h10.4154.60提前96h12.5045.44

表1 不同时间壳寡糖预处理对油菜菌核病的影响
Table 1 The resistance of COS pretreated B.napus to S.sclerotiorum
2.2 LOX酶活性变化
不同处理后油菜植株LOX的活性变化如图2所示。处理叶在只接菌和COS预处理后接菌情况下,72h小后活力提高,而COS处理的植株96h后活力才提高,且COS处理后的植株LOX活力高于只接菌者。在系统叶中获利变化更明显,在48时有一个峰值,96h水平又明显提高一个途径使SOD酶活升高。这些复杂现象说明在油菜中COS可通过多种途径诱导LOX活力升高。
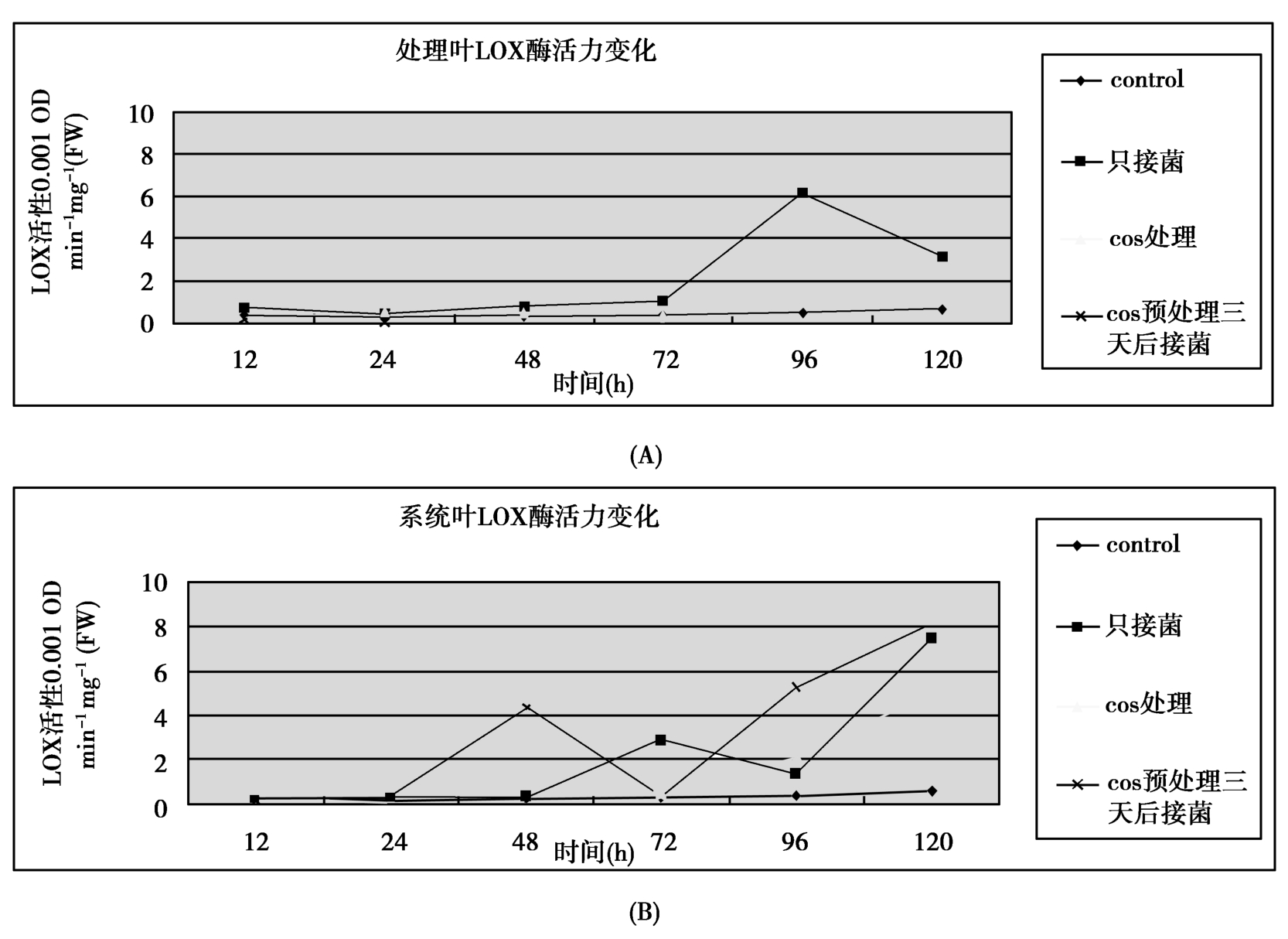
图2 壳寡糖和核盘菌引起的LOX酶活力变化 (A)处理叶 (B)系统叶
Figure 2 Effects of oligochitosan and S.sclerotiorum on activities of LOX enzymes in B.napus leafs.(A)Treat leafs (B) System leafs
2.3 抑菌试验结果
如表2所示,低浓度壳寡糖对核盘菌的直接抑制作用不明显。
壳寡糖浓度(mg/kg)抑菌圈直径(cm)壳寡糖浓度(mg/kg)抑菌圈直径(cm)0—5000.34±0.0550无抑制10000.75±0.11100无抑制

表2 不同浓度壳寡糖对核盘菌的抑菌圈直径
Table 2 The inhibitory diameter of S.sclerotiorum by different concentration COS
3 结论与讨论
壳寡糖作为近几年研究较多的一种植物诱抗剂,已经被广泛应用于烟草、棉花、油菜等作物生产中。然而其作用机制尚不明了,本文首次进行了壳寡糖对油菜抗菌核病的研究。发现使用50μg/ml的壳寡糖溶液预处理油菜植株,可以提高其抗菌核病能力,其抗性可持续96h以上,防效可达到54.60%。防治效果虽然没有化学药剂作用明显
壳寡糖对核盘菌的生长没有显著抑制作用,于汉寿等人也发现壳聚糖对核盘菌的直接抑制作用也不明显
提前三天预处理的植株有最高防效,说明壳寡糖诱导对菌核病的抗性可能有一个响应和滞后期,Molloy等人
脂氧合酶(LOX)在植物抗胁迫响应时扮演重要角色









