Optimization of Liquid Fermentation Conditions of Bacillus subtilis Xi-55
枯草芽孢杆菌(Bacillus subtilis)是土壤和植物微生态的优势种群,内生芽孢,抗逆能力强,繁殖速度快,营养要求简单,对农作物安全。作为植物根际有益微生物,通过分泌抗生物质和生长竞争,在防治植物病害方面发挥多种有益作用[1]。剂型以活体芽孢为主,田间施用可以较长时间的发挥抑制病菌作用[2~3]。
枯草芽孢杆菌Xi-55是本课题组从水稻植株上分离、筛选出来的一株活性较强的生防菌株,研究发现对多种植物病原菌具有良好的防治作用[4]。芽孢杆菌的发酵培养是工业化大规模生产芽孢杆菌制剂的前提。本文对所筛选出的枯草芽孢杆菌的发酵条件进行优化,进行20L发酵罐的放大培养研究,以提高其发酵水平,为芽孢杆菌制剂的工业化生产提供参考依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 枯草芽孢杆菌Xi-55,四川省农业科学院植物保护研究所分离获得。
1.1.2 培养基 斜面培养基(LB培养基):酵母膏5g,蛋白胨10g,NaCl 10g,琼脂15g,蒸馏水1000ml,pH值7.0。
种子培养基(BPY培养基):牛肉膏5g,蛋白胨10g,NaCl 5g,酵母膏 5g,葡萄糖 5g,蒸馏水1000ml,pH值7.0。
基础发酵培养基(KB培养基):蛋白胨 20g,甘油 10ml,K2HPO4 1.5g,MgSO4·7H2O 1.5g,蒸馏水1000ml,pH值7.0。
1.2 方法
1.2.1 培养方法 将保存在斜面上的菌种用接种环以划线形式接入LB平板上,28℃恒温培养24h活化。将活化的菌株接入装有100ml种子培养基的250ml三角瓶中,在28℃,180rpm条件下,振荡培养36~48h,制备液体种。按1%的接种量接入发酵培养基(100ml/250ml三角瓶),摇床振荡培养,测定发酵菌数量。
1.2.2 生长量的测定 采用平板菌落记数法。培养液用10倍梯度稀释法稀释6~7个梯度(101,102,103,……,107)后,选择3个稀释度较高的梯度稀释液,分别吸取50μl在LB平板上,然后用灭菌的L形玻棒将菌液涂匀,每梯度重复3次。28℃恒温培养24~36h后,调查平板上的菌落数,然后计算活菌数(cfu/ml)[5]。
1.2.3 培养基的优化 采用正交表L9(34)[6],四因素三水平安排试验。
1.2.4 发酵条件的优化 采用优化培养基通过单因子试验,测定不同时间、温度、初始pH值、接种量和装液量对发酵菌数的影响。
1.2.5 扩大培养 采用德国产Biostat C 20L全自动液体发酵罐,配制发酵培养基10L,添加消泡剂CXX-910 0.5‰。种子培养及接种量均同摇瓶试验。发酵技术参数设为:发酵温度28℃±0.5℃,通气量10L/min,搅拌转速180rpm,溶氧控制设定为以通气量为主、转速为辅,罐压0.05~0.06MPa,初始pH值为7.2。每隔4h取样,测定发酵菌数和观察芽孢形成情况,同时记录罐体内pH值变化。分别以培养时间为横坐标,菌数和pH值为纵坐标,绘制枯草芽孢杆菌在发酵罐中培养的生长曲线和pH值曲线。
2 结果与分析
2.1 培养基优化
采用L9(34)正交设计方案,分四因素三水平对Xi-55发酵培养,测定高峰期菌数,正交试验因素水平见表1,正交设计及结果见表2,极差分析见表3。结果表明:4种营养成分对其菌数影响的顺序是A>C>D>B,培养基成分优化组合为A3B2C1D3,即蛋白胨3%,甘油1.0%,K2HPO4 0.05%,MgSO4·7H2O 0.15%。
试验因素Experimentalfactor水平(Level)(%)123蛋白胨(Peptone)123甘油(Glycerine)0.51.01.5K2HPO40.050.100.15MgSO4·7H2O0.050.100.15
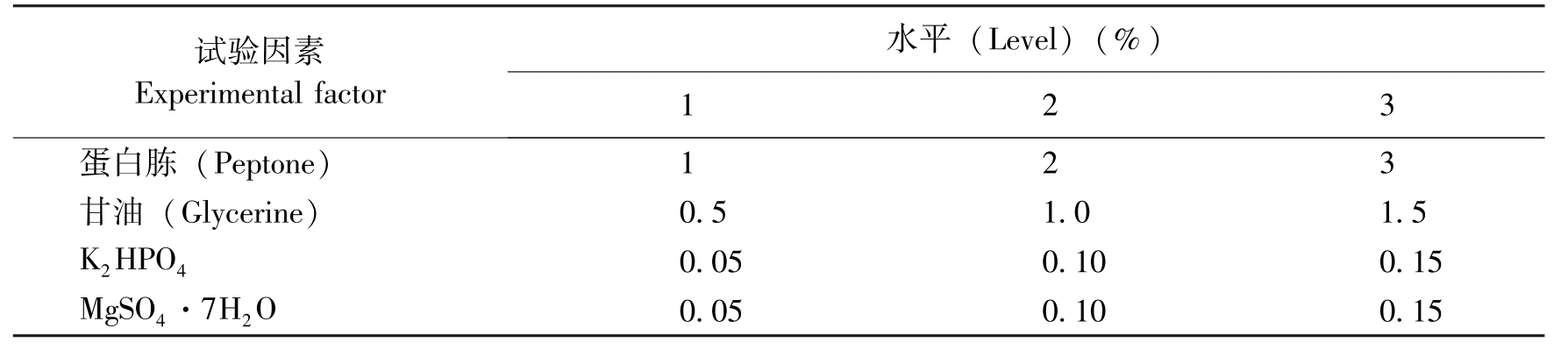
表1 培养基优化正交试验因素水平
Table 1 Orthogonal experimental factor levels for medium optimization
试验号Experimentalnumble水平(Level)(%)A[蛋白胨]PeptoneB[甘油]GlycerineC[K2HPO4]D[MgSO4·7H2O]菌数(Bacteriumamount)(109cfu/ml)111117.01212225.25313331.834212318.585223110.92623129.927313211.428321325.259332123.00
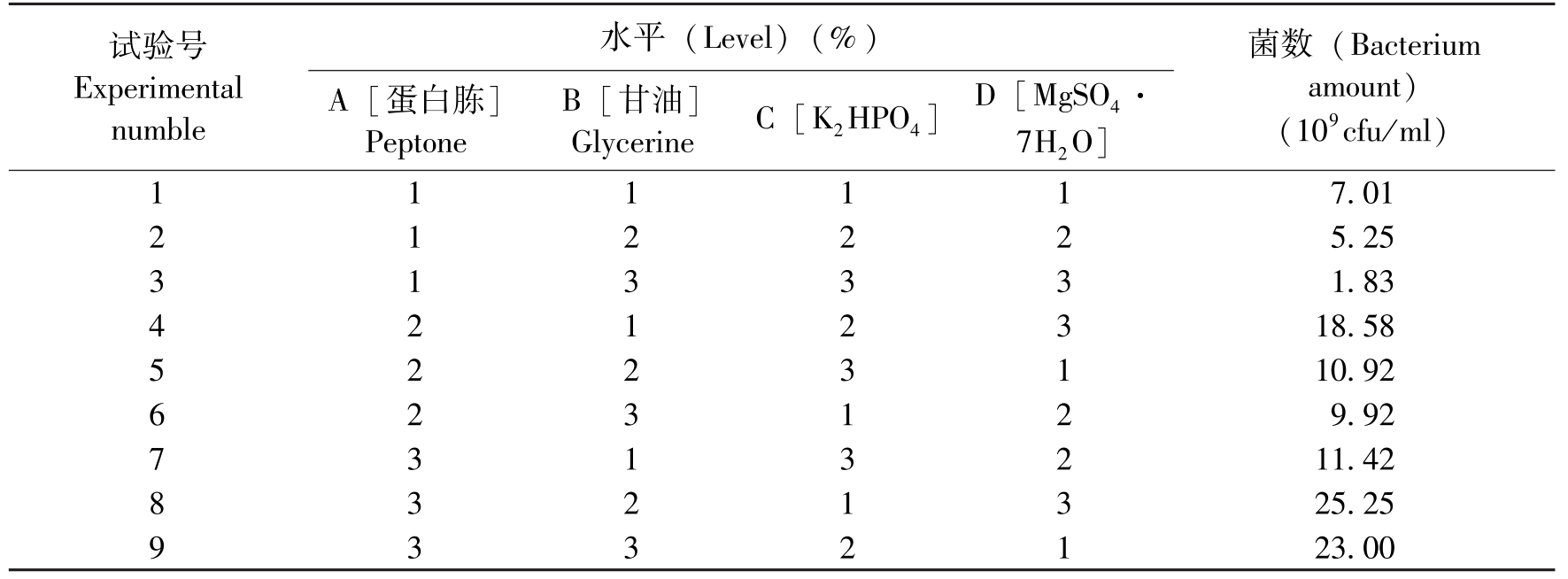
表2 培养基优化L9(34)正交设计及结果
Table 2 L9(34) orthogonal design and results for medium opitization
A[蛋白胨]PeptoneB[甘油]GlycerineC[K2HPO4]D[MgSO4·7H2O]K14.7012.3315.6113.64K213.1413.8114.068.86K319.8911.588.0615.22R15.192.237.556.36优化组合Optimization-groupA3B2C1D3因素顺序FactororderA>C>D>B
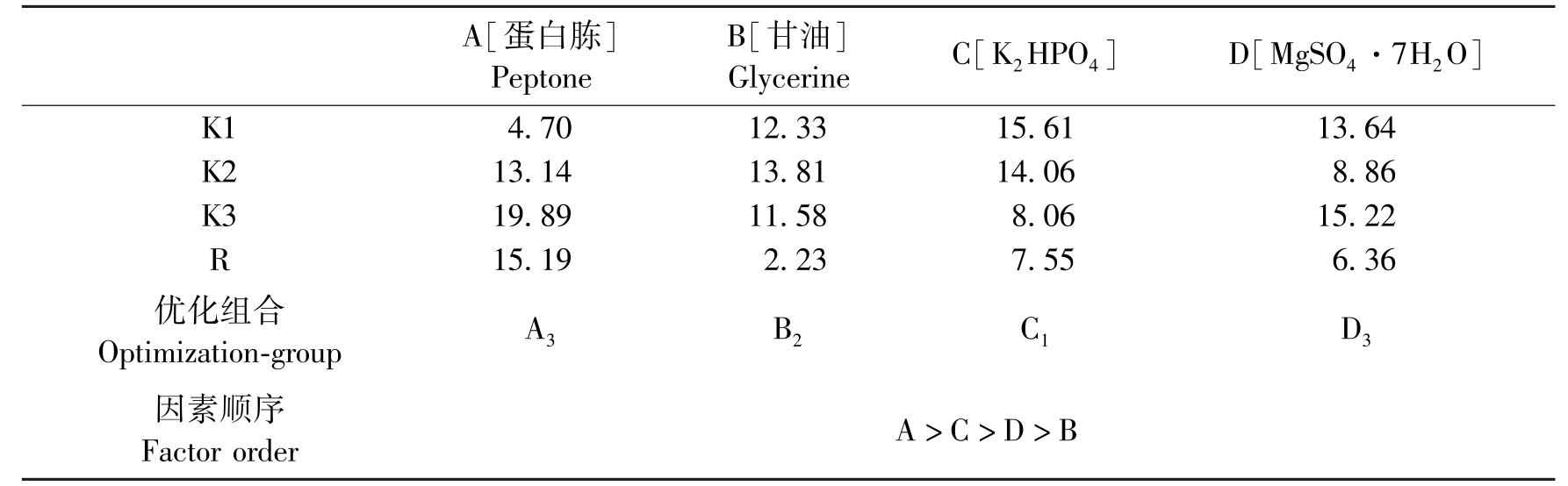
表3 培养基优化L9(34)的极差分析
Table 3 Range analysis of L9(34) for medium opitization
2.2 发酵条件优化
2.2.1 时间对Xi-55发酵细菌数量的影响 每隔12h从摇床上取样,测定发酵液中细菌数量,绘制Xi-55生长曲线。结果显示(图1),在发酵0~12h 之间,菌体生长繁殖缓慢;12~36h 为菌体生长加速期,也为菌体繁殖高峰时期,发酵液内细菌数量明显增加;36~48h为稳定期,菌体数量基本稳定;60h以后为孢子衰亡期,活菌由于自身产生的分解物质而使菌体分解,发酵液变透明。根据该试验结果,36~48h为Xi-55适宜发酵时间。
2.2.2 温度对Xi-55发酵细菌数量的影响 分别置于24℃、26℃、28℃、30℃和32℃摇瓶培养,测定不同培养温度的生长量,结果表明(图2),28℃细菌数量最高,28~30℃细菌数基本稳定,低于28℃和超过30℃菌数明显下降。所以28~30℃为Xi-55适宜发酵温度。
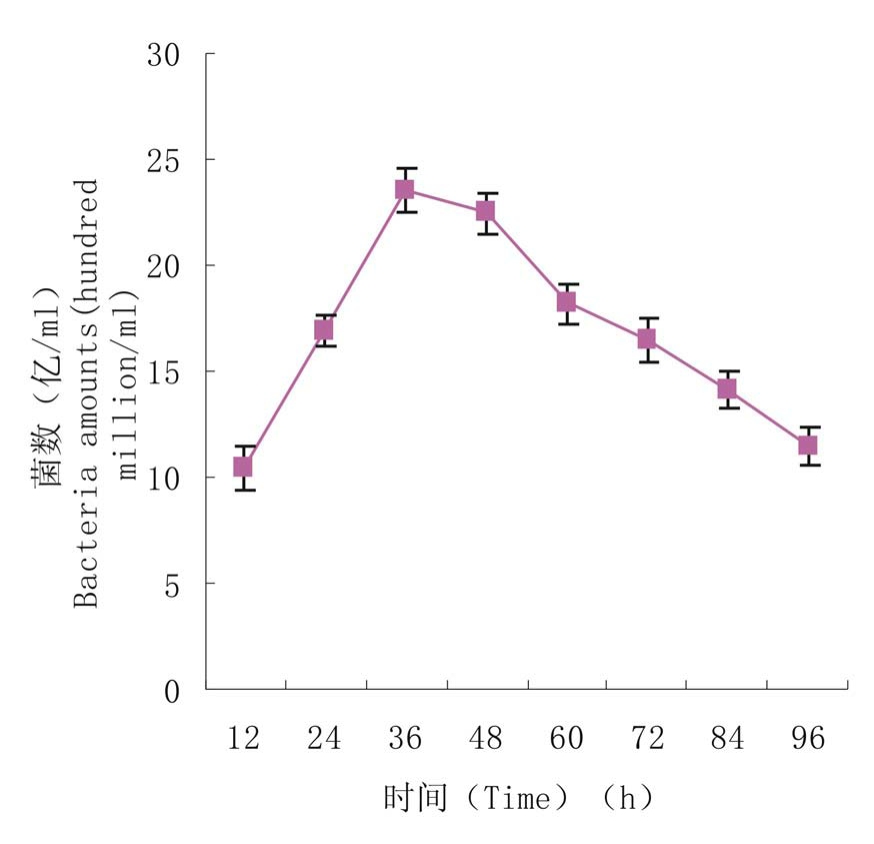
图1 时间对发酵菌数的影响
Figure 1 Effects of time on the bacteria amount
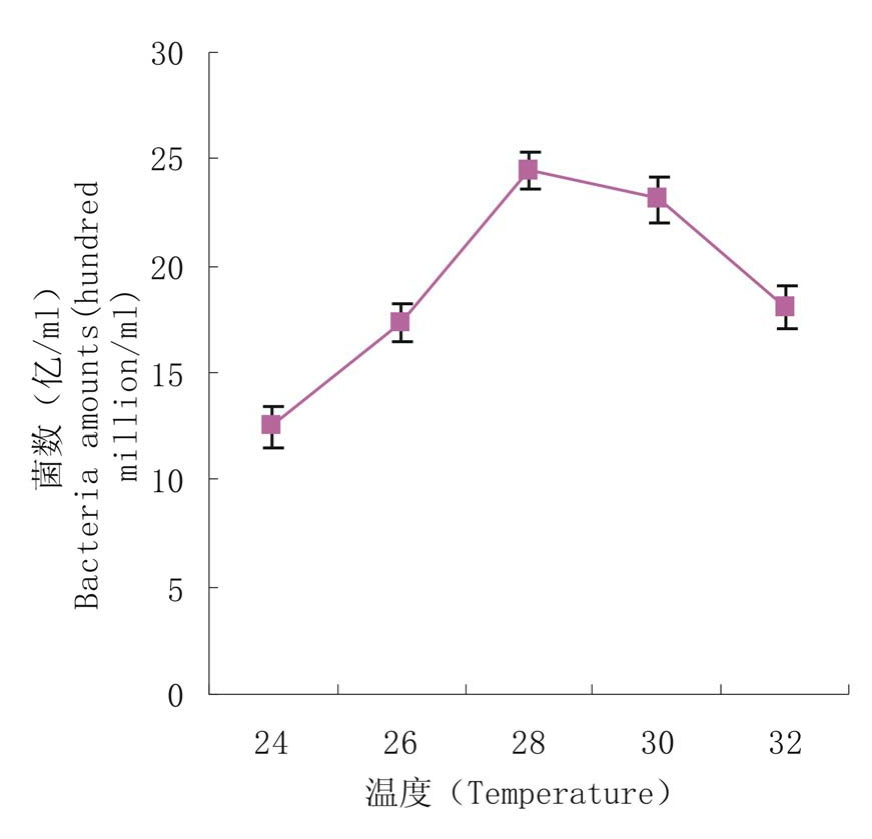
图2 温度对发酵菌数的影响
Figure 2 Effects of temperature on the bacteria amount
2.2.3 初始pH值对Xi-55发酵细菌数量的影响 设定pH值分别为5,6,7,8,9的培养基摇瓶培养,测定细菌生长量。结果显示(图3),当pH值为7时,细菌数量最高,当pH值为 7~8时,细菌数量基本稳定;pH值低于7和超过8,菌数明显减少;且 pH值为9或5时,菌体数量急剧减少或为零,据此推断pH值高于9或低于5时,Xi-55生长可能严重受抑制甚至不能生长,有待进一步研究。所以发酵培养基的适宜初始pH值为7~8。
2.2.4 接种量对Xi-55发酵菌数的影响 分别采用0.5%、1%、2%、3%、4%等5个接种量梯度摇瓶培养,测定细菌生长量,结果显示(图4),接种量在0.5%~2%范围内,菌量数随接种量的增加而增加,接种量为2%时,菌量数最高;接种量超过2%,菌数明显减少。总体上来看,菌体生长量并非随着接种量的增加而增加,而是有一个限度。所以,2%为最佳接种量。
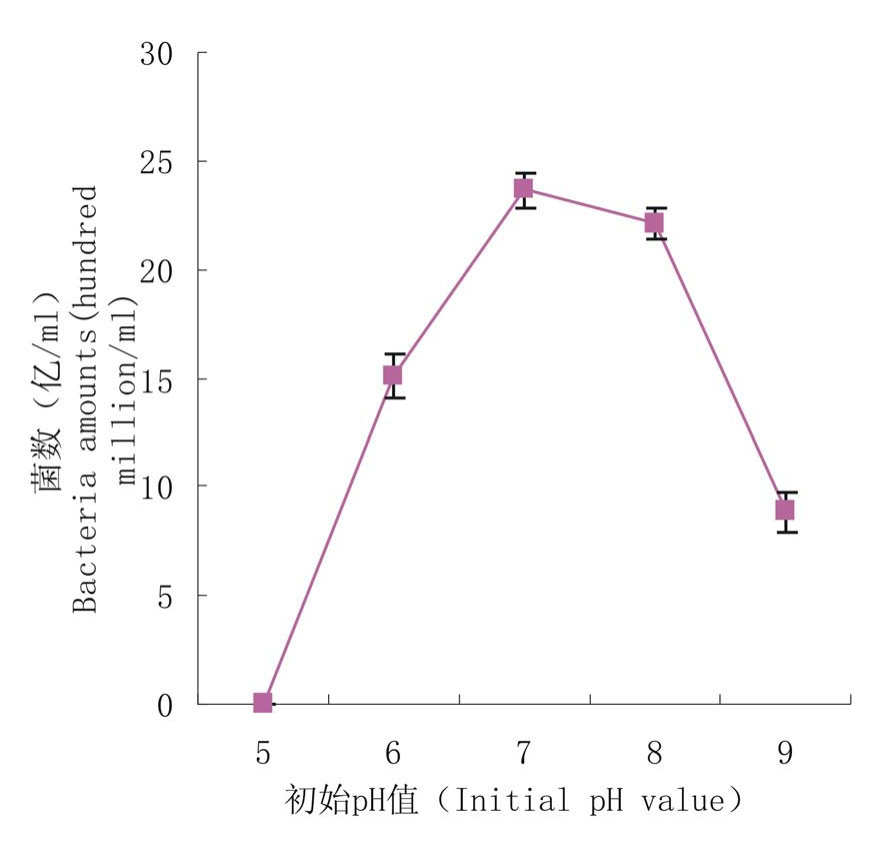
图3 初始pH值对发酵菌数的影响
Figure 3 Effects of initial pH value on bacteria amount
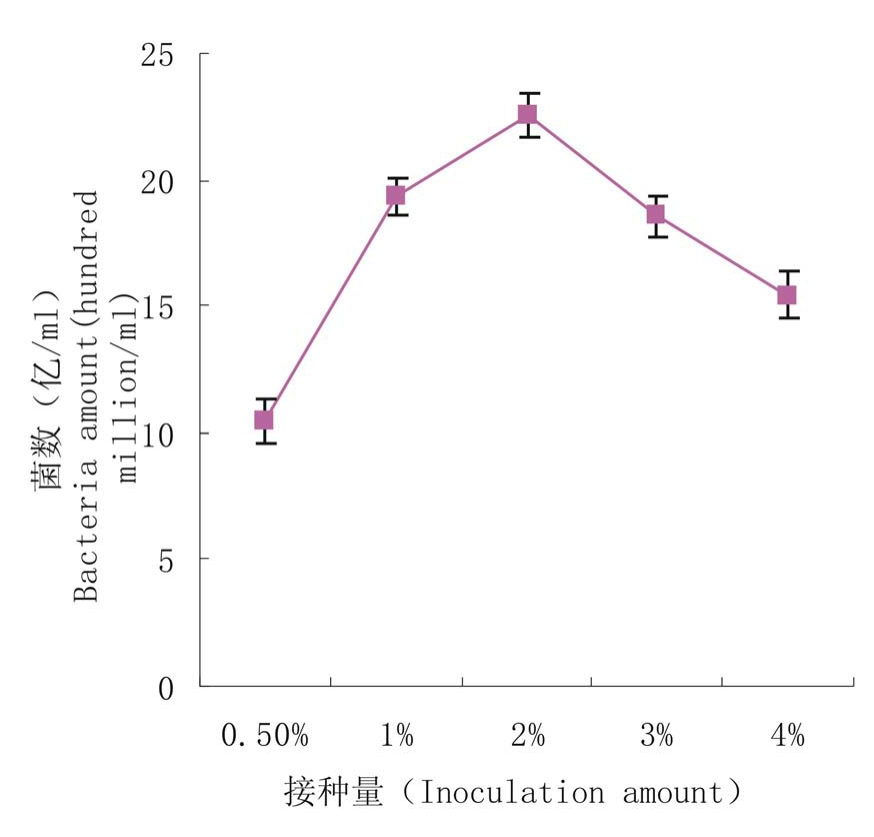
图4 接种量对发酵菌数的影响
Figure 4 Effects of inoculation amount on bacteria amount
2.2.5 装液量对Xi-55发酵菌数的影响 采用装液量分别为50ml/500ml、100ml/500ml、150ml/500ml、200ml/500ml锥形瓶摇床振荡培养,测定细菌生长量,试验结果表明,通过摇瓶装液量的不同来调节通气量对Xi-55发酵菌数有较大影响。一定范围内,装液量越少,则通气量越高,氧气供应越充足,那么细菌数量就越高。50ml与100ml装液量差别不明显,但从总生长量考虑,100ml/500ml锥形瓶为最佳装液量(图5)。
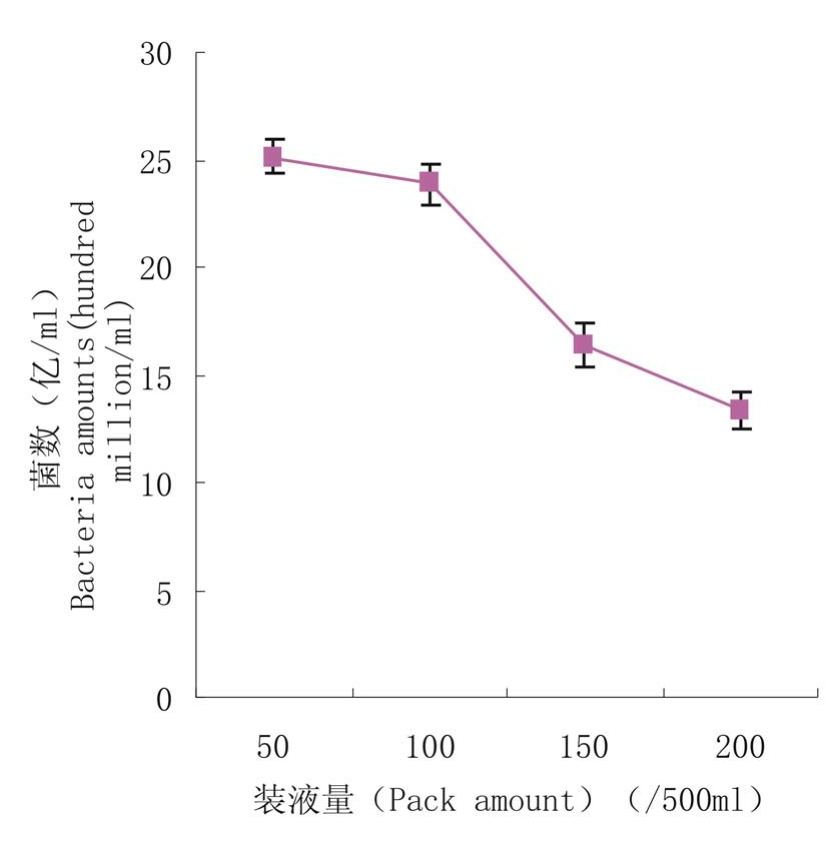
图5 装液量对发酵菌数的影响
Figure 5 Effects of pack amount on bacteria amount
2.3 扩大培养
在摇瓶优化发酵条件的基础上,进行了20L发酵罐的扩大培养。从生长曲线(图6)可以看出,发酵罐扩大培养的发酵周期与摇瓶发酵周期基本一致。由于发酵罐的搅拌和通氧条件均优于摇瓶发酵,因此,菌体浓度和芽孢同步形成率都明显优于摇瓶发酵。36h菌体数量达到最高量,50.61×109cfu/ml;然后进入稳定期,开始大量形成芽孢,44h形成芽孢90%以上。分析pH值曲线(图6)发现,初始pH值7.2,随着菌体生长,pH值缓慢下降;对数生长期菌体迅速繁殖,pH值也急剧下降,表明菌体大量利用养分产生了酸性物质;稳定期随着芽孢逐渐形成,pH值回升,44~48h时,芽孢数量达到最大;52h以后pH值上升至7.4左右,可以看到菌体碎片,细胞自溶,表明生长和代谢受到抑制。因此,发酵终止应在52h前,最佳放罐时间应在44~48h。
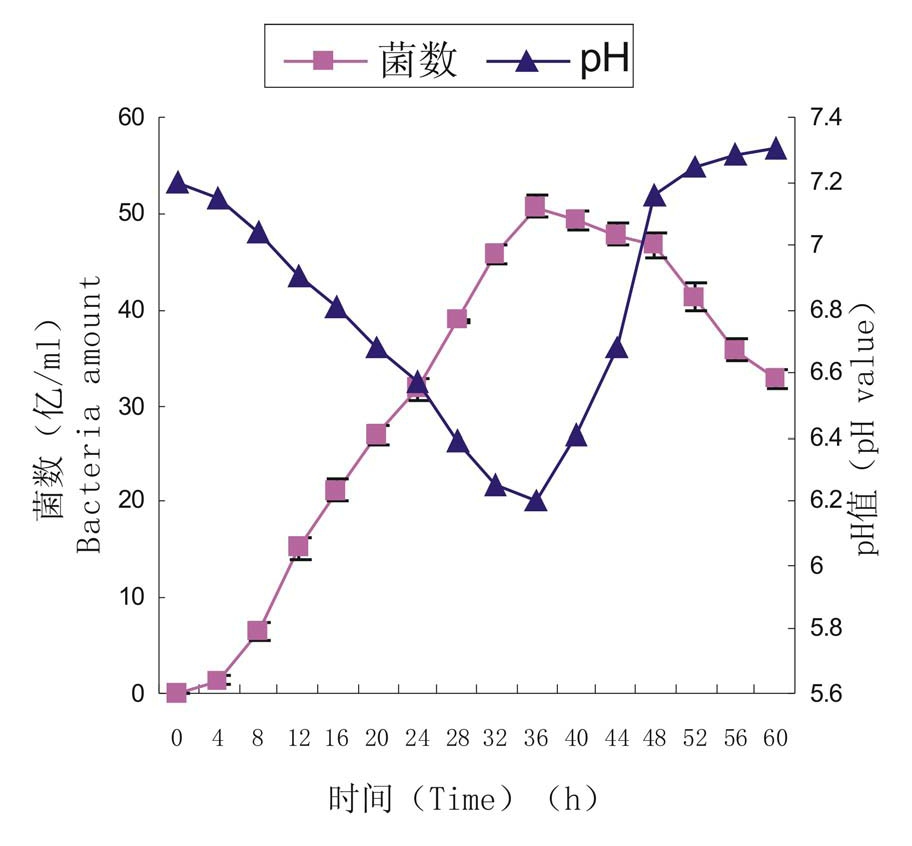
图6 20L发酵罐中的生长与pH值曲线
Figure 6 The growth and pH curve in 20L fermentation tank
3 结论与讨论
从以上试验可以看出,培养基的组成和时间、温度、培养基初始pH值、接种量、通气量、摇床转速等培养条件均对菌株的生长有很大的影响。通过单因子试验和正交试验方法,确定枯草芽孢杆菌Xi-55优化培养基为:蛋白胨3%,甘油1.0%,K2HPO4 0.05%,MgSO4·7H2O 0.15%;优化发酵条件为:时间36~48h,温度28~30℃,初始pH值7~8,接种量2%,装液量100ml/500ml锥形瓶,摇床转速180~200rpm。并进行了发酵罐扩大培养,36h达到生长高峰期,最适放罐时间44~48h;此时所获得的菌体数量约为50亿个/ml,为大规模工业化发酵培养提供了有益借鉴。
在发酵过程中发现,发酵液的黏度较大,很容易产生泡沫,必须用消泡剂来消除。而本试验中采用的发酵专用含硅消泡剂CXX-910对pH值有轻微影响,故添加消泡剂不宜过多。操作时可预先在培养基里添加少量消泡剂,然后通过发酵罐上的补料装置在发酵过程中自行控制补充,这样可以在满足消泡的同时尽量降低消泡剂的添加量,减少消泡剂对pH值的影响,比一次性添加或单纯通过补料装置添加效果要好。


















